Q&A【ザノサーをご使用いただくにあたって】
- Q.血管外漏出時の組織障害性のカテゴリーは?
-
A.
抗がん薬の血管外漏出時の組織障害性については、壊死起因性薬剤(Vesicants)炎症性薬剤(Irritants)、非壊死性薬剤(Nonvesicants)に分類されており、ザノサー(ストレプトゾシン)は、炎症性抗がん剤に分類されています。
Perez Fidalgo JA., et al. : Ann Oncol. 2012 ; 23(Suppl.7) : ⅶ167-ⅶ173.
閉じる
- Q.悪心・嘔吐のカテゴリーは? また、悪心・嘔吐に対する対処法は?
-
A.
ザノサー(ストレプトゾシン)は、日本癌治療学会の「がん診療ガイドライン」の「制吐薬適正使用ガイドライン」では、高度催吐性リスクの薬剤に分類されています。
当ガイドラインの「制吐療法 注射抗がん薬に対する制吐薬治療のダイアグラム」では、高度催吐性リスクの抗がん薬に対する制吐療法は以下のように推奨されています。高度催吐性リスクの注射抗がん薬に対する制吐療法

制吐薬適正使用ガイドライン 2015年10月 【第2版】(日本癌治療学会 編、金原出版、2015)、p.21
ガイドラインでは、上記のように抗催吐性抗悪性腫瘍剤に対しては〔アプレピタント(またはホスアプレピタント)+ 5-HT3受容体拮抗薬 + デキサメタゾン〕の3剤併用療法が推奨されていますが、ザノサーの国内第Ⅰ/Ⅱ相試験においては大部分の症例は制吐剤2剤併用(5-HT3受容体拮抗薬 + デキサメタゾン)が使用されており、アプレピタントが使用されていた症例は2例のみでした。
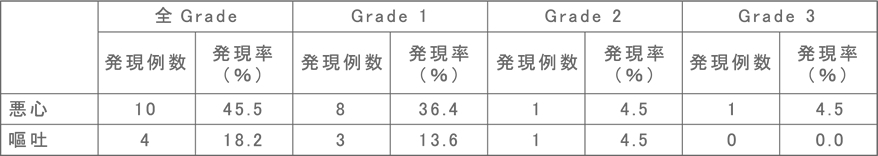
国内第Ⅰ/Ⅱ相試験における悪心・嘔吐の発現頻度
国内第Ⅰ/Ⅱ相試験では、プレメディケーションとして悪心・嘔吐に対し、全例に5-HT3受容体拮抗薬、NK1受容体拮抗薬等の制吐剤またはデキサメタゾン投与を行っていました。 その結果、大部分はGrade 1-2であり、投与中止に至った症例は認められませんでした。
閉じる
- Q.《用法・用量に関連する使用上の注意》として、「腎毒性を軽減するために輸液を行い、尿量確保に注意すること」と記載されていますが、どれくらいの輸液が必要ですか?
-
A.
特に規定はありません。
国内第Ⅰ/Ⅱ相試験において、血漿中濃度測定時は下記のプロトコールで投与を行いました。
1回あたりの輸液量は950mLでした。1. 電解質輸液(500mL) 120分 2. 電解質輸液(100mL)
+ 制吐剤30分 3. 電解質輸液(100mL)
+ 本剤投与30分 (±5分) 4. 電解質輸液(250mL) 60分 本剤投与中は尿量確保に留意し、必要に応じてマンニトール
及びフロセミドなどの利尿剤を投与する。Total 約4時間血漿中濃度測定時以外の投与時においても、1回の投与あたりおおよそ950mLの輸液量でした。
なお、使用された輸液は、生理食塩液、電解質ブドウ糖液、酢酸リンゲル液、乳酸リンゲル液 等でした。閉じる
Q&A【その他】
- Q.他の抗悪性腫瘍剤と併用してもよいですか?
-
A.
国際的診療ガイドライン及び欧米のNET専門学会の治療ガイドライン1-5)では、転移性で切除不可能な膵及び消化管神経内分泌腫瘍に対し、ストレプトゾシン(STZ)単独、STZ+ドキソルビシンあるいはSTZ+フルオロウラシルの併用療法が標準治療として推奨されています。
しかし、日本人の患者に対する安全性は充分確認されておりません。また、これらの薬剤との併用により骨髄機能抑制等の作用が増強する可能性があり、注意が必要です。そのため、併用する際には患者の状態を十分に観察し、異常が認められた場合には、減量、休薬等の適切な処置を行ってください。1)NCI PDQ. Islet Cell Tumors (Endocrine Pancreas) Treatment.
(National Cancer Institute Physician Data Query)
(http://www.cancer.gov/cancertopics/types/isletcell)2)NCI PDQ. Gastrointestinal Carcinoid Tumors Treatment.(http://www.cancer.gov/cancertopics/pdq/treatment/gastrointestinalcarcinoid/)3)NCCN Clinical Practice Guidelines in Oncology –Neuroendocrine Tumors- ver. 2, 2014.
(http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#site)4)Eriksson B., et al. : Neuroendocrinology 2009 ; 90 (2) : 214–219.5)Pavel M., et al. : Neuroendocrinology 2012 ; 95 (2) : 157–176.閉じる
- Q.術前又は術後の補助化学療法として本剤を投与してもよいですか?
-
A.
本剤の術前又は術後の補助化学療法における有効性及び安全性は確立していません。そのため、術前又は術後の補助化学療法として本剤を投与することは推奨できません。
閉じる
- Q.副作用発現時の、休薬・減量・中止・増量の方法に規定はありますか?
-
A.
5 日間連日投与、及び1週間間隔投与それぞれに休薬、中止の基準が設けられています。また1週間間隔投与には減量、増量の基準が設けられています。5日間連日投与に関しては減量、増量は認められておりません。詳しくは添付文書の《用法・用量に関連する使用上の注意》をご参照ください(当該部分の抜粋を以下に示します)。
《用法・用量に関連する使用上の注意》より抜粋転載<休薬基準>
5 日間連日投与法において、以下に示した程度の副作用が認められた場合は、休薬すること。副作用 程度 好中球数減少 500/mm3未満の場合、1,500/mm3以上に回復するまで休薬する。 発熱性好中球減少症 Grade 3注の場合、回復するまで休薬する。 血小板数減少 5万/mm3未満の場合、10万/mm3以上に回復するまで休薬する。 非血液毒性(肝転移を有する
患者では、γ-GTPを除く)Grade 3注の場合、Grade 2注以下に回復するまで休薬する。 血清クレアチニン上昇 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 1週間間隔投与法において、以下に示した程度の副作用が認められた場合は、休薬すること。
副作用 程度 好中球数減少 1,500/mm3未満の場合、1,500/mm3以上に回復するまで休薬する。 発熱性好中球減少症 Grade 3注の場合、回復するまで休薬する。 血小板数減少 10万/mm3未満の場合、10万/mm3以上に回復するまで休薬する。 非血液毒性(肝転移を有する
患者では、γ-GTPを除く)Grade 3注の場合、Grade 2注以下かつ毒性が許容可能となるまで休薬する。 血清クレアチニン上昇 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 総ビリルビン上昇 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 AST及びALT上昇 施設基準値の2.5倍を超える場合、2.5倍以下に回復するまで休薬する。肝転移を有する患者では施設基準値の5倍を超える場合、5倍以下に回復するまで休薬する。 血清尿素窒素上昇 30mg/dLを超える場合、30mg/dL以下に回復するまで休薬する。 悪心・嘔吐 Grade 3注の場合、Grade 2注以下に回復するまで休薬する。 <減量基準>
1週間間隔投与法において、以下に示した程度の副作用が認められた場合は、休薬後の投与再開時に、投与量を1段階(250mg/m2)ずつ減量すること。ただし、750mg/m2未満での投与及び減量後の増量は行わないこと。副作用 程度 好中球数減少 500/mm3未満 発熱性好中球減少症 Grade 3注 血小板数減少 5万/mm3未満 非血液毒性(肝転移を有する
患者では、γ-GTPを除く)Grade 3注 血清クレアチニン上昇 施設基準値の1.5倍を超える場合 <中止基準>
5日間連日投与法において、以下に示した程度の副作用が認められた場合、又は連続で4週間以上の休薬を要する副作用が認められた場合は、本剤の投与を中止すること。副作用 程度 発熱性好中球減少症 以下のいずれかの条件を満たす場合: 1)
Grade 4注が発現した場合
2)
Grade 3注の発現後に回復し、投与再開後、
再度Grade 3注以上が発現した場合血小板数減少 5万/mm3未満となった後に回復し、投与再開後、再度5万/mm3未満になった場合 非血液毒性(肝転移を有する
患者では、γ-GTPを除く)Grade 4注 腎障害 重篤な腎障害が発現した場合 糖尿病 コントロールできない糖尿病が発現した場合 1週間間隔投与法において、以下に示した程度の副作用が認められた場合、又は連続で4週間以上の休薬を要する副作用が認められた場合は、本剤の投与を中止すること。
副作用 程度 好中球数減少 500/mm3未満となった後に回復し、減量投与にも
係わらず、再度500/mm3未満になった場合発熱性好中球減少症 以下のいずれかの条件を満たす場合 : 1)
Grade 4注が発現した場合
2)
Grade 3注の発現後に回復し、減量投与にも
係わらず、再度Grade 3注以上が発現した場合血小板数減少 5万/mm3未満となった後に回復し、減量投与にも
係わらず、再度5万/mm3未満になった場合非血液毒性(肝転移を有する
患者では、γ-GTPを除く)Grade 4注 腎障害 重篤な腎障害が発現した場合 糖尿病 コントロールできない糖尿病が発現した場合 <増量基準>
1週間間隔投与法において、1回1,000mg/m2で投与を開始し、12週目までの忍容性が良好な場合には、1回1,250mg/m2に増量することができる。 さらに18週目までの忍容性が認められる場合には、最大1回1,500mg/m2まで増量することができる。(注:GradeはCTCAE ver.4.0に準じる。)
閉じる
- Q.腎機能障害のある患者にザノサーを投与してもよいですか? また、薬物動態に影響はありますか?
-
A.
腎障害のある患者は慎重投与となっていますのでご注意ください。国内第Ⅰ/Ⅱ相試験に腎障害のある患者は組み入れられていませんが、ストレプトゾシン及び代謝物は主に尿中排泄されることから、腎障害がストレプトゾシンの排泄へ影響を及ぼす可能性があると考えられます。また、本剤により腎障害の発現が認められている(頻度不明*)ので、腎障害のある患者に本剤を投与すると副作用が強くあらわれるおそれがあります。投与開始前に腎機能を評価し、慎重に投与してください。
*外国でのみ認められている副作用
閉じる
- Q.糖尿病の患者にザノサーを投与してもよいですか?
-
A.
糖尿病の患者は慎重投与となっていますのでご注意ください。国内第Ⅰ/Ⅱ相試験において、耐糖能異常に関連する有害事象(尿中ブドウ糖陽性7例、高血糖4例、糖尿病2例)を発現した8例中の5例が糖尿病を合併していました。糖尿病の既往歴を有する患者における耐糖能異常の発現率が高いことからも、投与開始前に患者の状態を十分に観察し、慎重に投与してください。
閉じる
- Q.高齢者にザノサーを投与してもよいですか?
-
A.
高齢者は慎重投与となっていますのでご注意ください。一般的に、高齢者では生理機能が低下していることが多いので、患者の状態を観察しながら慎重に投与してください。
本剤の国内第Ⅰ/Ⅱ相試験では65歳以上が2例であり、外国の添付文書でも65歳以上の患者数が不十分なため、若年者群と有効性及び安全性が異なるか評価されていません。閉じる
- Q.肝機能障害のある患者にザノサーを投与してもよいですか?
-
A.
本剤の投与により、γ-GTP、AST(GOT)、ALT(GPT)等の上昇を伴う肝障害があらわれることがありますので、患者の状態を十分に観察して適切な処置が行えるように、投与開始前に肝機能を評価し、投与期間中も定期的に肝機能検査を実施してください。これまでに肝機能障害を有する患者を対象とした薬物動態試験は実施されておらず、ストレプトゾシンが当該患者の薬物動態へ及ぼす影響は不明です。
閉じる
- Q.ストレプトゾシンは妊婦に対する影響があるのでしょうか?
-
A.
妊婦又は妊娠している可能性のある婦人は禁忌となっています。妊娠可能な女性及びパートナーが妊娠する可能性のある男性に対しては、適切な避妊法を用いるよう指導をお願いしております。
妊婦への投与に関する試験成績はこれまで得られていませんが、動物試験(ウサギ、ラット)で流産促進作用や催奇形性が、また雌雄ラットに投与した場合、生殖機能への影響が認められたとの報告があります6)7)。適切な避妊期間については、動物試験及び臨床試験で検討されていないため確かな情報はありません。ただし、「国立がん研究センターがん対策情報センターによるがん情報サービス8)の抗がん剤による性機能障害(女性)」の項目に、「卵子の発育期間中に抗がん剤の影響を受けた卵子の受精は、胎児異常を発生する可能性があります。治療後6ヵ月程度は避妊することが望ましい。」とされていることから、本剤についてもこの基準を参考に対応する必要があると考えられます。
これらを踏まえて、妊婦及び胎児に対する安全性の確保のために、妊娠する可能性のある女性及びパートナーが妊娠する可能性のある男性に対して、「投与期間中及び投与終了後6ヵ月程度、有効な避妊法を用いることが望ましい。」ことを指導してください。6)企業中核データシート(Streptozocin Core Data Sheet, 2009年1月版)7)外国の添付文書[米国(2007年 5月版)、欧州(Summary of Product Characteristics、2010年7月版)]8)抗がん剤による性機能障害
(http://ganjoho.jp/public/dia_tre/attention/chemotherapy/side_effect/sexual_dysfunction.html)閉じる
- Q.ストレプトゾシンは授乳に対する影響があるのでしょうか?
-
A.
本剤がヒトの乳汁中に移行するか否かは不明です。乳児に対する安全性を確保するため本剤投与中の患者には授乳を避けるように指導してください。
閉じる
- Q.過量に投与した場合どうしたらよいですか?
-
A.
海外で最高7.5g/m2週まで投与され、汎血球減少症、敗血症、無尿、高窒素血症、腎不全、心不全等が報告されています。本剤の過量投与に対する既知の解毒剤はありませんので、投与量を注意して計算するなど、考えられる対策を講じて過量投与を回避してください。
閉じる
PAGE TOP
